
#胆管癌(Cholangiocarcinoma, CCA)是一种源于胆道系统、高度异质性的恶性肿瘤,其治疗一直是临床面临的重大挑战。近几十年来,CCA的全球发病率持续上升,但患者预后普遍较差,5年总生存率仅为7%-20%。
免疫检查点抑制剂(如抗PD-1疗法)在CCA中的疗效有限,单药治疗的客观缓解率仅约26%;即使与一线化疗联合使用,其中位总生存期也仅能延长约1个月。
针对这一临床困境,2025 年 6 月 26 日,山东大学齐鲁医院徐云飞、张宗利、荆卫强、潘畅团队在Cancer Cell(IF=44.5)杂志发表了题为“Bile acids activate cancer-associated fibroblasts and induce an immunosuppressive microenvironment in cholangiocarcinoma”的研究论文。
该研究揭示了胆汁酸代谢重编程CAF诱导免疫抑制的完整通路,阐明了CCA免疫治疗耐药的机制核心,并确定GPBAR1/CXCL10为CCA的潜在免疫治疗靶点,为 CCA 治疗提供新方向。

高 BA 微环境与 CAFs 的未解之谜
最新研究发现,胆管癌肿瘤微环境(TME)中胆汁酸浓度显著高于其他肿瘤,而癌症相关成纤维细胞(CAFs)作为 TME 的关键组分,其是否以及怎样调控 TME 及 CCA 的进展尚不清楚。
研究团队将目光投向了 CCA 的两个独特之处。
一方面,CCA肿瘤处于胆汁酸(BA)富集的微环境中,胆管内BA浓度可达300 mM,远高于肠道,且在胆管狭窄时BA水平会进一步升高。既往研究已表明BA可调控T细胞功能,但它对肿瘤微环境中其他细胞的影响尚不明确。
另一方面,CAFs是CCA的组织学标志,其能通过分泌多种因子塑造免疫抑制性的TME。然而,CAFs与免疫细胞在CCA中的相互作用尚未得到系统研究,且目前缺乏针对CAFs的有效治疗靶点。
基于此,本研究旨在揭示BA是否通过激活CAFs驱动免疫逃逸,进而解释CCA免疫治疗耐药的机制,并探索新的治疗靶点,为改善CCA的治疗效果提供理论依据。

多维度实验解析
研究团队通过多维度的实验体系,从临床队列分析、机制探索到临床前治疗验证,逐步解析BA-CAFs-免疫抑制轴的分子机制。
临床发现与靶点筛选
在临床队列分析中,研究人员对157例CCA患者进行研究,发现高血清BA水平与肿瘤体积增大、淋巴结转移及CD8⁺T细胞耗竭呈正相关。
同时,通过对人及鼠CCA组织进行单细胞测序,结果显示GPBAR1(BA膜受体)在CCA的CAFs中特异性高表达,而在其他癌种(如乳腺癌、胃癌)的CAFs中不表达。
进一步研究发现,CAFs中GPBAR1表达与分化程度、血管侵犯、TNM分期负相关,且预示着患者的不良预后。
机制解析:BA-GPBAR1-CXCL10轴驱动免疫抑制
在动物模型验证方面,采用原位CCA模型,通过CAF特异性敲除GPBAR1(S100a4-CreERT2; Gpbar1ᶠˡᵒˣ小鼠),发现其能显著抑制肿瘤生长与转移,延长小鼠生存期;而使用BA激动剂INT777,通过激活GPBAR1可促进肿瘤进展,增加T细胞耗竭。
在分子通路研究中,揭示了BA激活GPBAR1后,通过Gαs-cAMP-PKA信号上调转录因子SOX4,进而诱导CXCL10分泌,实现对CAFs的重编程。同时,CAF来源的CXCL10结合肿瘤细胞CXCR3,激活PI3K-AKT-TRIB3通路,促进TWIST1介导的上皮-间质转化(EMT),增强肿瘤侵袭能力。
此外,CXCL10还能招募中性粒细胞,通过TLR4(非CXCR3)信号维持其未成熟表型(高表达ARG1/MPO/弹性蛋白酶),从而抑制CD8⁺T细胞功能。

治疗转化:靶向GPBAR1/CXCL10增强免疫疗效
在临床前模型(人源化PD-1小鼠+原位CCA)中,研究发现GPBAR1抑制剂(SBI-115)或CXCL10中和抗体单用可抑制肿瘤进展;而SBI-115联合抗PD-1(帕博利珠单抗)能显著提升疗效,逆转BA诱导的免疫治疗耐药。另外,对52例接受ICI治疗的CCA患者进行分析,结果显示高血清BA或CAFs高GPBAR1表达预示着抗PD-1治疗响应差、患者生存期短。
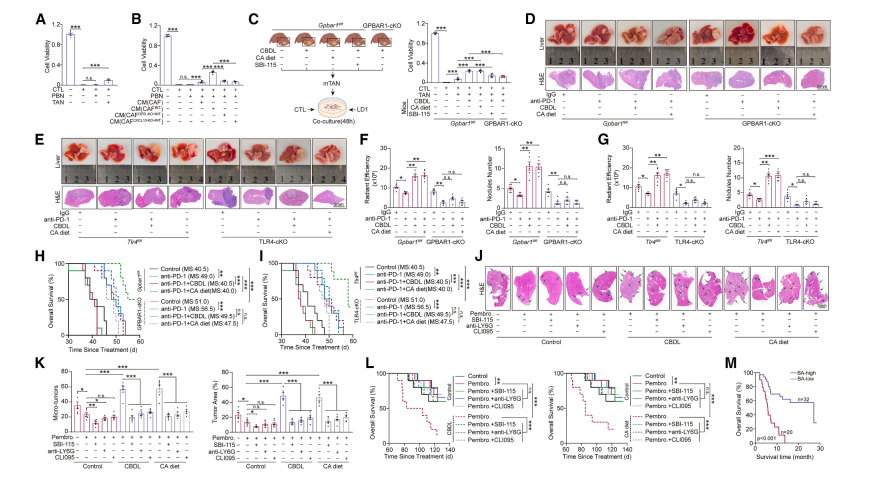
研究首次发现“BA-GPBAR1-CXCL10轴”是CCA特有的免疫逃逸通路。具体而言,BA通过激活CAFs上的GPBAR1,诱导CXCL10分泌,这一过程既促进了肿瘤的EMT,又招募了未成熟中性粒细胞,从而形成了双重免疫抑制微环境。
同时,还发现CAF来源的CXCL10通过TLR4信号维持中性粒细胞的未成熟状态,增强了其免疫抑制功能。
明确了GPBAR1和CXCL10是改善CCA免疫治疗的潜在靶点。抑制GPBAR1可逆转BA诱导的免疫抑制,使“冷肿瘤”转化为“热肿瘤”。并且提出了联合治疗策略,即GPBAR1抑制剂与抗PD-1联用可显著提升疗效。
最后指出血清BA水平和肿瘤CAFs的GPBAR1表达可作为预测CCA免疫治疗响应的生物标志物,这有助于指导患者分层,为个性化治疗提供依据。